8
8
3、进口与非进口化妆品是如何划分的
化妆品根据罐装完成的地域,又分国产化妆品和进口化妆品。
进口化妆品:是指最后一道接触内容物的(分装/罐装)工序在境外(含港澳台)完成的产品。
国产化妆品:是指最后一道接触内容物的(分装/罐装)工序在境内(中国大陆)完成的产品。
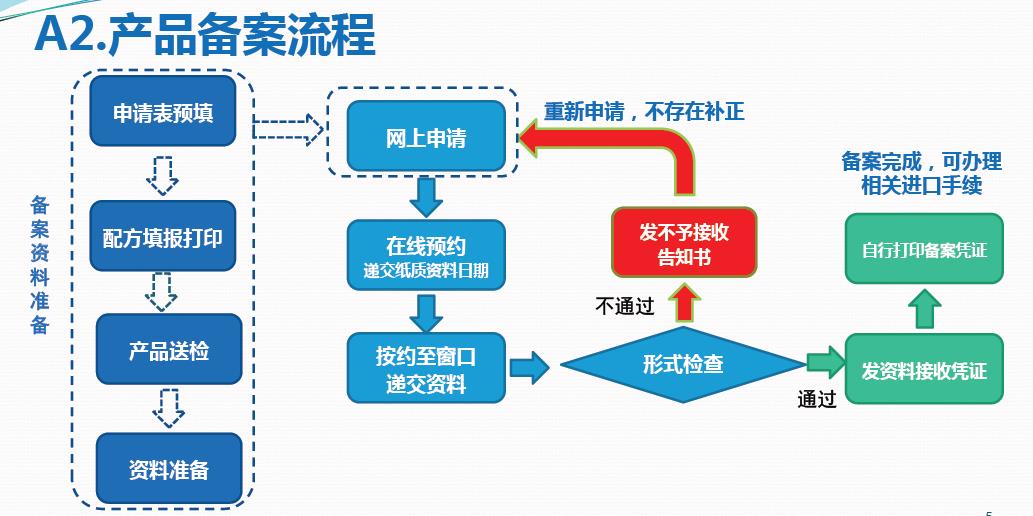
进口化妆品备案
近年来,国外化妆品受到大陆爱美女士的追捧。据说成都和大连的对国外化妆品的购买力,把国外的厂家都给吓着了。
“日韩同属亚洲,皮肤相似,中国人倾向日韩系的很多,较近出现高端品纷纷涌入的迹象,也是因为他们等待的中国市场逐渐成熟。”较近和一业内人士聊天时她这样描述。
化妆品的利润是大家有目共睹的,但是进口化妆品厂家也有不少头疼事:
一是关税太高,各种税率加起来差不多50%。
二是行政卫生许可证审批比较困难,周期长,花费大。
三是海关很难对付呀!不光架子大,脾气也都不小。
所以很多贸易公司干脆就采用让货代公司从中国香港量少次多的方式进货,同时直接采用网上销售,直销的方式进行。
但是这种方法,因为没有国家的行政卫生许可证,对于想通过正规销售,开通商场超市渠道的品牌,时刻得提心吊胆的担心国家工商部门的查处,国家以后会对化妆品类的产品监管会越来越严格。
因此,对于化妆品贸易公司,特别是对一些品牌的总代理,还是应该尽早拿下化妆品行政卫生许可批件。有了批件,就意味着畅通的销售渠道,更大的销售量,品牌的建立,消费者更大的认可。同时,有了批件,部分货物也可以通过中国香港特殊方式进口,意味着更大的利润。
可能对于企业来说,较大的问题就是如何拿下这个批件。我是专门做化妆品注册申报的,深知企业面对纷繁的法规,不知从何下手。所以我承诺免费义务咨询申报的事宜。如果大家碰到什么难题,欢迎和我联系。
汇诚佳业国际企业管理有限公司,是专业从事进口及国产化妆品申报注册的咨询机构,主营业务进口特殊/非特殊用途、国产特殊用途化妆品《行政许可批件/备案凭证》(以下简称《批件》),同时提供客户标签制作、商标申请、协助海关报关和代理公司注册、化妆品政策法规及相关信息的解读等审批配套业务。公司创始人于08年开办化妆品代理申报公司,后续变更至现在公司,至今已十余年申报经验。
我们一直致力于化妆品申报的研究,公司员工均系此领域*专业人员及外聘*,业务娴熟,技术力量雄厚。已经为国内外数百家化妆品生产企业和经销商成功获取申报批文,尤其对韩国、闽台、日本、欧洲等国家有丰富的业务经验和资源。取得合作伙伴的一致认可。
我们秉承着:诚信专业,严谨认真,优质周详,高效快捷的服务理念,以客户的较大利益为目的,帮助您更快的把握市场先机。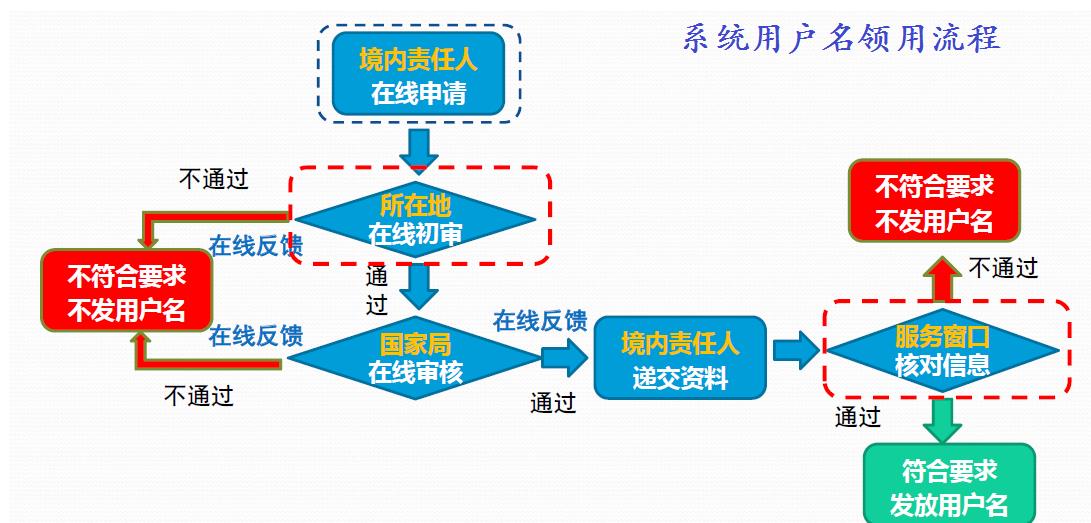
批文到期了,延续有什么要求?
(一) 技术审评原则
1) 原申报资料符合现行规定的内容不得更改。不符合现行规定且可按有关要求调整的,应当予以调整,必要时需补充提交有关检验资料等申报资料。
2) 延续后的产品,应当符合现行化妆品相关规定。
(二)技术要求
3) 申报资料应当真实、合法,其内容及形式应当符合化妆品行政许可申报受理规定的要求。
4) 申请表填写应当完整,其内容应当包含产品及生产企业的基本信息,特殊情况应当予以说明。
5) 延续产品的中文名称应当符合化妆品命名规定及其指南的要求。
对不符合化妆品命名规定及其指南要求,但需要保留原产品中文名称的,应当在延续时提出申请并说明理由。
产品中文名称命名依据在原申报资料中已提交且产品名称无变化的,不需要再次提交。
6) 产品配方应当包含原料序号、国际化妆品原料名称(国产产品除外)、标准中文名称、百分含量、使用目的等内容。复配原料应当按复配形式申报(香精除外)。同时,产品配方还应当提供该产品中文名称,进口产品应当同时提供外文名称,不能提供的应当予以说明。
现配方成分及含量与原配方应当一致。按照现行要求以复配形式申报的,如增加了溶剂、稳定剂、防腐剂等,且不影响产品安全性的除外。
按照复配形式申报后,该复配原料各成分的含量总和应当与原配方中该原料含量一致。
7) 产品质量安全控制要求应当包括申报产品的实际控制指标及其具体控制要求,并承诺产品符合我国化妆品卫生规范要求。
国产产品中的产品质量安全控制指标若执行国家标准或行业标准,应当同时提供相关标准的名称、标准号和具体的指标要求。
8) 产品应当提交在中国市场销售的产品包装(含产品标签、产品说明书),国产产品如未上市,可提交产品设计包装(含产品标签、产品说明书)。
国产产品需同时提交申请人所在地省级食品药品监督管理部门出具的关于产品生产、上市、监督意见书或未上市的审核意见。
9) 产品的中文标签、说明书应当符合化妆品标签说明书管理的相关规定。
10) 产品的原申报资料中相关检验资料与现行化妆品行政许可检验规范及化妆品卫生规范规定的检验项目和检验方法不符合的,应当补充或重新进行检验。
11) 有下列情况之一者,应当按照化妆品中可能存在的安全性风险物质风险评估指南及相关要求提交安全性评估资料:
(a)产品原申报资料中未提交可能存在安全性风险物质相关安全性评估资料的;
(b)产品原申报资料中已提交相关安全性评估资料,但随着科学的发展,对相关安全风险评估认识有变化的。
12) 产品原申报资料中未提交需由第三方出具证明文件的,延续时申报资料中应当补充提交第三方出具的证明文件,文件应当真实、合法,并符合相关要求。
(三) 判定原则
13) 延续产品符合现行化妆品相关法律法规、标准规范的规定,且符合本技术审评要点有关要求的,判定为“建议批准”。
14) 延续产品符合下列情况之一者,判定为“补充资料,延期再审”:
(a)需要补充或重新进行检验的;
(b)需要申请人提供解释说明的;
(c)需由第三方出具证明文件的;
(d)其他需要修改、补充资料的情况。
15) 延续产品符合下列情况之一者,判定为“建议不批准”:
(a)产品配方不符合化妆品卫生规范要求的。
1.产品配方含有现行化妆品卫生规范规定的禁用物质;
2.产品配方中限用物质、防晒剂、着色剂、防腐剂、染发剂等的使用不符合现行化妆品卫生规范要求的。
(b)申报资料或样品不真实的。
1.产品配方以外的其他申报资料显示产品生产使用的原料种类或含量与申报配方不符的;
2.提交虚假第三方证明文件的;
3.提交虚假送审样品或送检样品的;
4.申报资料中外文未如实翻译为中文,影响审评结论的;
5.其他申报资料或样品不真实的情况。
(c)产品配方与原申报资料中配方相比发生改变的。
(d)检验结果不符合现行化妆品卫生规范及相关规定的;检验结果不符合产品质量安全控制要求的;产品配方中所申报组分的种类或含量与实际检测结果不符的。
国家食品药品监督管理局技术审评机构应当根据审评工作的实际,确定检测结果的误差允许范围。
(e)产品质量安全控制要求发生改变的。
(f)依据申报资料无法判断产品的安全性,申请人无法按照要求提交补充资料的,或无法继续完成安全性评价的。
(g)补充资料时申请人自行改变产品配方、产品质量安全控制要求等内容,无法判断申报资料的真实性,影响审评结论的。
(h)产品配方中原料种类和含量与产品质量安全控制要求中的相应内容不相符的。
(i)产品申报的类别与相关规定不符的。
(j)其他不符合有关规定的情况。