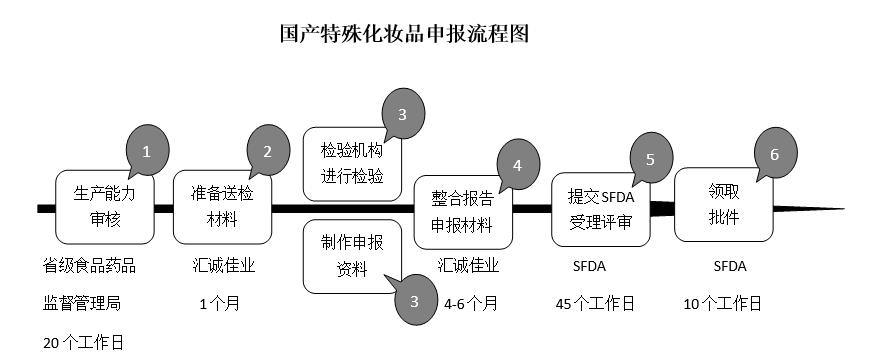
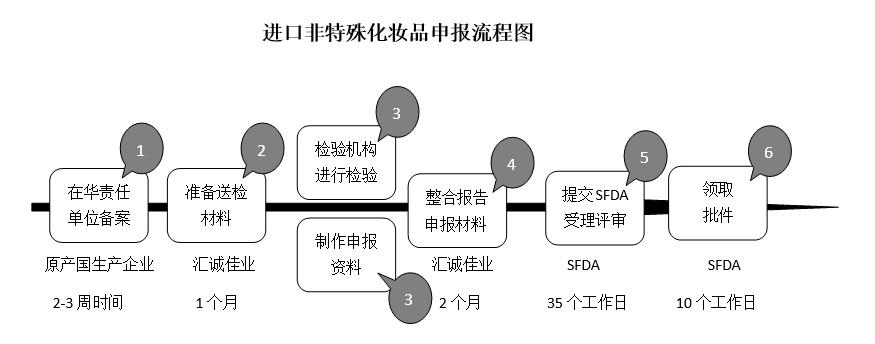
8
8
生产国(地区)生产和销售的证明文件应当符合哪些要求
生产国(地区)生产和销售的证明文件应当符合哪些要求
(一)由产品生产国或原产国(地区)**主管部门或行业协会出具。无法提交文件原件的,可提交复印件,复印件应经出具机构或我国使(领)馆确认;
(二)应载明产品名称、生产企业名称、出具文件的机构名称并**构印章或法定代表人(或其授权人)签名及文件出具日期;
(三)所载明的产品名称和生产企业名称应与所申报的内容完全一致;如为委托加工或其他方式生产,其证明文件所载明的生产企业与所申报的内容不一致时,应由申请人出具证明文件予以说明;必须配合使用的多剂型产品可仅提交产品进口部分的生产和销售证明文件;
(四)生产和销售证明文件如为外文,应译为规范的中文,中文译文应由中国公证机关公证。
复配原料该如何申报?
复配原料(包括植物提取物)应按复配物的形式申报,如“卡松”应分别申报甲基氯异噻唑啉酮、甲基异噻唑林酮、水、氯化镁、硝酸镁的含量。
变更、纠错可以同时进行吗?
申请人应当分别申请延续、变更、补发、纠错等事项,在完成一个申请事项后,方可申请其他事项。申请人申请变更行政许可事项时,可同时申请多个事项的变更。
因申请变更、纠错化妆品行政许可批件(备案凭证)而未能在《受理规定》规定时限内提出延续申请的,应当在领取变更、纠错化妆品行政许可批件(备案凭证)后15日内提出延续申请,但变更、纠错申请应当在该化妆品行政许可批件(备案凭证)期满4个月前提出。
申请退回资料和补充资料的时限有哪些要求?
申请人在接到“不予行政许可决定书”或“不予延续/变更行政许可决定书”之日起6个月内,可书面向国家食品药品监督管理局审评机构提出退回资料申请。
申请人接到行政许可技术审查延期通知书后,应按照通知书规定的补充资料时限要求提交补充资料。对逾期未提交的,应当作出不予许可决定。
申请在华申报责任单位授权书备案的资料有哪些?
申请在华申报责任单位授权书备案时,除按有关规定提交相关文件外,还应同时提交在华申报责任单位营业执照复印件。在华申报责任单位授权书内容除应符合《化妆品行政许可申报资料要求》*二十三条相关要求外,还应注明生产企业和在华申报责任单位地址信息。生产企业地址应与进口化妆品(新原料)行政许可申请表中相应内容一致,在华申报责任单位地址应与营业执照中相应内容一致,生产企业应对地址信息的真实性和相关申报资料中地址信息的一致性负责。

1:国外已经上市的产品,为什么国内申报受阻?
很多客户有疑问,产品在欧美都上市销售很多年了,欧美的标准比中国的标准高多了,配方成分经过了国外*检测机构验证,也经过这么多年的使用都没有问题,为什么在中国却不行?中国化妆品法规对于新原料的使用较为谨慎,一些在国外非常流行的成分(例如蜗牛,胎盘提取物)都禁止使用,官方理由是因为他们还没有明确的安全性结论和足够的实际使用安全性验证。所以请不要想当然的认为国外上市的产品,在国内一定能很*的获得批文。
2:国外产品的包装可以直接进入中国吗?
原则上应该使用国外产品的包装进入中国,再贴中文标签。但实际中很多的情况是:国外的配方中有中国法规禁用的成分,包装的功效宣传也不符合中国法规的要求(例如药妆),那么就只能修改包装设计,制作符合中国法规要求的包装,修改包括删除禁用成分,删除或修改夸大性功效宣传。另外,产品一旦送检,检测机构就会对样品进行封包,封样会随同其他资料一同送药监局审查,所以一旦送检,包装和配方都不能再改。因此,我们的技术老师会在送检前仔细审核,确保检测费不要白花。
3:生产国(地区)生产和销售的证明文件应当符合哪些要求?
(一)由产品生产国或原产国(地区)**主管部门或行业协会出具。无法提交文件原件的,可提交复印件,复印件应经出具机构或我国使(领)馆确认;
(二)应载明产品名称、生产企业名称、出具文件的机构名称并**构印章或法定代表人(或其授权人)签名及文件出具日期;
(三)所载明的产品名称和生产企业名称应与所申报的内容完全一致;如为委托加工或其他方式生产,其证明文件所载明的生产企业与所申报的内容不一致时,应由申请人出具证明文件予以说明;必须配合使用的多剂型产品可仅提交产品进口部分的生产和销售证明文件;
(四)生产和销售证明文件如为外文,应译为规范的中文,中文译文应由中国公证机关公证。
4:批文的有效期是几年?
化妆品行政许可批件(备案凭证)有效期四年。
申请人申请延续化妆品行政许可批件(备案凭证)有效期的,应当在化妆品行政许可批件(备案凭证)期满4个月前提出申请。
因补发化妆品行政许可批件(备案凭证)而未能在规定时限内提出延续申请的,应当在领取补发化妆品行政许可批件(备案凭证)后15日内提出延续申请,但补发申请应当在该化妆品行政许可批件(备案凭证)期满4个月前提出。